مقدمه و مبانی باتری
باتری (battery)، مجموعهای از یک یا چند سلول است که با انجام واکنشهای شیمیایی، جریان الکترونها در درون مدار را ایجاد میکند. همه باتریها از سه جز اصلی تشکیل شدهاند: یک آنود (anode) یا همان قسمت منفی (-)، یک کاتد (cathode) یا همان قسمت مثبت (+) و نوعی الکترولیت (یک ماده شیمیایی که با آند و کاتد واکنش میدهد).
زمانی که آند و کاتد یک باتری به مدار متصل است، یک واکنش شیمیایی بین آند و الکترولیت اتفاق میافتد. این واکنش، باعث جریان الکترونها در درون مدار و برگشت آنها به کاتد شده و در آنجا (کاتد)، یک واکنش دیگر رخ میدهد. زمانی که مواد موجود در کاتد یا آند مصرف شده یا دیگر در واکنش قابل استفاده نباشد، باتری دیگر قادر به تولید الکتریسیته نخواهد بود. در آن حالت، باتری اصطلاحاً «مرده» است.
باتریهایی که بعد از استفاده دور انداخته میشوند، به عنوان «باتری اولیه» شناخته میشوند. به باتریهای قابل شارژ، «باتری ثانویه» میگویند.
تاریخچه
اصطلاح باتری
از نظر تاریخی، واژه «باتری» برای توصیف «مجموعهای از اشیا مشابه که برای انجام عملکرد خاصی در کنار هم قرار گرفتهاند»، مانند یک آتشبار (Artillery battery) استفاده شده است. در سال 1749 میلادی، بنجامین فرانکلین (Benjamin Franklin) برای اولین بار از این اصطلاح، به منظور توصیف یک سری خازن استفاده کرد که برای انجام آزمایشهای الکتریکی خود به هم متصل کرده بود. بعدها این اصطلاح، برای همه سلولهای الکتروشیمیایی استفاده شد که به منظور فراهم کردن نیروی الکتریکی به هم متصل شدهاند.

باتری خازنهای بطری لیدن (Leyden Jar) در اتصال با یکدیگر
اختراع باتری
در یک روز سرنوشتساز در سال 1780 میلادی، فیزیکدان، پزشک، زیستشناس و فیلسوف ایتالیایی، لوییجی گالوانی (Luigi Galvani)، در حال کالبدشکافی یک قورباغه آویزان از قلابی برنجی بود. زمانی که او پای قورباغه را با چاقوی جراحی آهنی لمس کرد، پای قورباغه جمع شد. گالوانی عقیده داشت که انرژی جمع شدن، از خود پا به وجود آمد ولی همکار او، آلساندرو ولتا، عقیدهی دیگری داشت.
ولتا فرض کرد که حرکتهای پای قورباغه در اثر برخورد فلزهای متفاوت خیس شده در مایع است. او این آزمایش را به جای جسد قورباغه، با استفاده از یک لباس خیسانده شده در آبنمک تکرار کرد که منجر به نتایجی با ولتاژ مشابه شد. ولتا، یافتههای خود را در سال 1791 منتشر کرد و در سال 1800، اولین باتری را با عنوان پیل ولتایی (Voltaic pile) ساخت.
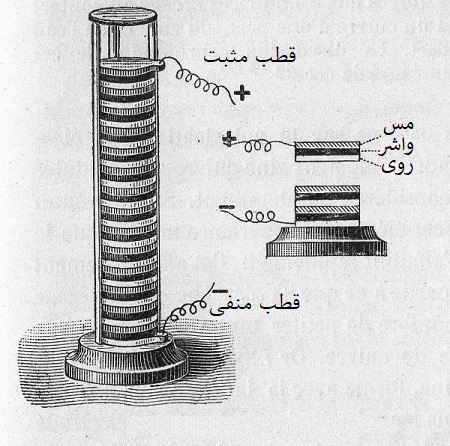
پیل ولتایی، شامل صفحههای روی و مس روی هم که به وسیله پارچه خیسانده شده در آبنمک از هم جدا شدهاند
پیل ولتایی، دو مشکل بزرگ داشت. اول این که وزن ناشی از صفحات روی هم باعث نشت الکترولیت از درون پارچه میشد. دوم این که خواص ویژه شیمیایی اجزای تشکیل دهنده، باعث طول عمر بسیار کوتاه باتری میشد (حدود 1 ساعت). تا 200 سال بعد، تحقیقات صرف بهبود عملکرد طراحی ولتا و رفع این مشکلات شد.
رفع مشکلات پیل ولتایی
ویلیام کرویکشانگ (William Cruickshank) اسکاتلندی، مشکل نشت را با قرار دادن پیل ولتایی به صورت «باتری افقی» حل کرد.

باتری افقی، مشکل نشت پیل ولتایی را حل کرد
مشکل دوم (طول عمر کوتاه)، ناشی از تخریب روی بر اثر وجود ناخالصیها و ایجاد حبابهای هیدروژن بر روی مس بود. در سال 1835 میلادی، ویلیام استورجن (William Sturgeon) کشف کرد که تقویت روی با جیوه، از تخریب آن جلوگیری میکند.
شیمیدان بریتانیایی، جان فردریک دانیل (John Frederic Daniell)، از یک الکترولیت ثانویه استفاده کرد. این الکترولیت، جهت جلوگیری از انباشته شدن هیدروژن بر روی کاتد مس، با آن واکنش میداد. باتری دو الکترولیتی دانیل، به عنوان سلول دانیل (Daniell cell) شناخته میشود. این باتری، محبوبیت زیادی در فراهم کردن انرژی شبکههای نوپای تلگراف داشت.

مجموعهای از سلول دانیل، سال 1836
اولین باتری قابل شارژ
در سال 1859، فیزیکدان فرانسوی، گاستون پلانته (Gaston Planté)، با استفاده از دو ورق نورد شده سرب قرارگرفته در اسیدسولفوریک، یک باتری ساخت. با معکوس کردن جریان الکتریکی از طریق باطری، مواد شیمیایی به وضعیت قبلی خود باز میگشتند. این شروع اختراع اولین باتری قابل شارژ بود.
در سال 1881، کامیل آلفونس فوره (Camille Alphonse Faure)، عملکرد طراحی پلانته را با تبدیل ورقههای سرب به صفحات سرب بهبود بخشید. این طراحی جدید، تولید باتریها را آسانتر کرد. باتریهای سربی-اسیدی، کاربرد گستردهای در اوتوموبیلها پیدا کرد.

طراحی معمول «باتری ماشین» از حدود 100 سال پیش ایجاد شد
باتری خشک
تا اواخر سده 1800 میلادی، الکترولیت درون باتریها به صورت مایع بود. این مسئله، حملونقل باتریها را به یک کار بسیار محتاطانه تبدیل کرد. اکثر باتریها، به منظور جابجایی پس از اتصال به مدار ساخته نشده بودند.
در سال 1866، جورجز لکلانشه (Georges Leclanché)، با استفاده از آند روی، کاتد دیاکسید منگنز و محلول آمونیوم کلرید به عنوان الکترولیت، یک باتری ساخت. در حالی که الکترولیت درون سلول لکلانشه، مایع بود، ترکیبات شیمیایی باتری، قدم مهمی برای اختراع باتریهای خشک به حساب میآمد.







